Термодинамические параметры — что это? параметры состояния термодинамической системы
Содержание:
Второй способ записи основного уравнения МКТ
Определение
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
\(P*V = n*R*T \)
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
\(P=\frac{n*R*T}{V}\)
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
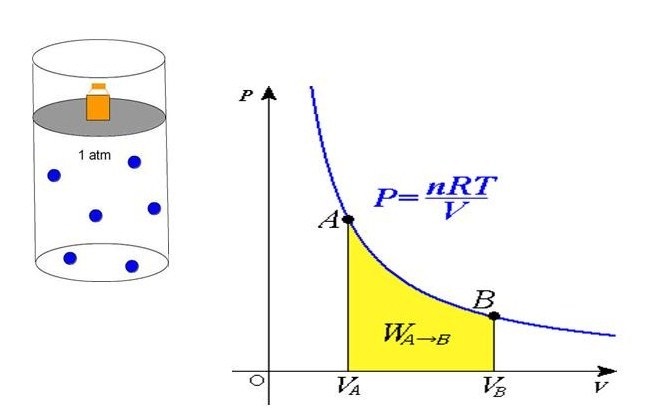
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m
В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
- Применение закона Дальтона, согласно которому давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
\(P=\frac{N*m*v^{2}}{3*V}\)
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
\(m=\frac{M}{NA}\)
\(n=\frac{N}{NA}\)
\(m*N= M*n\)
\(P=\frac{M*n*v^{2}}{3*V}\)
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
\(P=\frac{F}{S}\)
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
\(F*Δt = Δp\)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Физические свойства компонентов, входящих в состав природных газов
|
Параметр |
Метан СН4 |
Этан С2Н6 |
Пропан С3Н8 |
Н-Бутан С4Н10 |
И-Бутан С4Н10 |
н-Пентан С5Н12 |
|
Молярная |
16.04 |
30.07 |
44.09 |
58.12 |
58.12 |
72.15 |
|
Плотность, при |
0.717 0.669 |
1.356 1.264 |
2.010 1.872 |
2.307 2.519 |
2.673 2.491 |
3.457 3.228 |
|
Вязкость: Динамическая Кинематическая при |
1.020 1.102 14.24 16.18 |
0.880 0.940 6.35 7.28 |
0.770 0.820 3.70 4.26 |
0.690 0.760 2.45 2.95 |
||
|
Критические |
190.68 4.52 |
305.75 4.88 |
370.00 4.34 |
425.17 3.75 |
460.90 3.29 |
|
|
Газовая Дж/(кг×К) |
518.57 |
276.64 |
188.68 |
143.08 |
115.23 |
|
|
Теплота (при высшая |
39830 35880 |
70370 64430 |
100920 92930 |
133890 123680 |
131800 121750 |
158360 146230 |
|
Теплоемкость кДж/(кг×К) |
2.167 |
1.650 |
1.430 |
1.590 |
1.590 |
Продолжение
табл. 1.3
|
Азот N2 |
Водо-род Н2 |
Окись СО |
Двуо-кись СО2 |
Воздух СО2) |
Серо-водород |
|
|
Молярная |
28.02 |
2.016 |
44.01 |
64.07 |
28.96 |
34.02 |
|
Плотность, при |
1.2505 1.1651 |
0.0899 0.0837 |
1.2500 1.1651 |
1.9768 1.8423 |
1.2928 1.2050 |
1.5392 1.4338 |
|
Вязкость: Динамическая Кинематическая при |
1.71 1.84 — — |
— — — — |
— — — — |
1.40 1.65 — — |
1.745 1.822 — — |
1.23 — — — |
|
Критические |
126.26 3.45 |
33.30 1.32 |
133.00 3.44 |
304.26 7.28 |
132.65 3.777 |
373.60 8.89 |
|
Газовая Дж/(кг×К) |
296.75 |
4124.7 |
296.94 |
188.97 |
292.70 |
115.23 |
|
Теплота (при высшая |
— — |
12762 10798 |
12636 10649 |
— — |
— — |
25708 23698 |
|
Теплоемкость кДж/(кг×К) |
1.058 |
— |
— |
0.816 |
1.005 |
0.993 |
В
соответствии с нормами технологического проектирования псевдокритические параметры природного газа могут быть определены по
известной плотности rст
газовой смеси